医疗器械唯一标识技术实现自动医疗 ID 和条码读取
投稿人:DigiKey 北美编辑
2023-10-26
2013 年,美国食品药品监督管理局 (FDA) 实施了医疗器械唯一标识系统 (UDI) 规则。该规则的目的是借助现代文档在生产、分销和使用环节提供一致的医疗器械追踪和标识方法,从而提高患者安全性。与欧洲《医疗器械法规要求》或其他国家/地区的类似法规一样,美国的 UDI 规则提高了报告的准确性,便于在发生召回或不良事件时进行分析。
自 2023 年 9 月 24 日起,FDA 将对医疗器械标签和包装全面实行美国国家健康相关产品代码 (NHRIC) 和药品编码 (NDC)。任何在此日期或之后贴标的医疗产品都必须完全符合 UDI 规定。该规定将影响以下产品:
- 3 类生命安全攸关产品,如心脏起搏器和植入假体
- 2 类中等关键产品,如注射器、导管和可吸收缝线
- 1 类低风险产品,如牙线、医袍和氧气面罩
全面实行该规定意味着,如果医疗器械没有可扫描的条码,将不再被视为有效/可使用的产品,即使该产品上有人类可读的标签,即使普遍认为该产品很容易被大多数用户识别。这一全面实行将推动医疗行业和医疗保险结算领域全面采用 UDI。
 图 1:一些手持式直接零件标记 (DPM) 条码检测仪配备了先进的照明和其他软件,可自动查找符号并循环设置,以优化手头特定 DPM 标记和基材的读取。事实上,这里展示的 LVS-9585 可以同时检测 DPM 零件和打印标签,以便进行全面分析和报告。(图片来源:Omron Automation)
图 1:一些手持式直接零件标记 (DPM) 条码检测仪配备了先进的照明和其他软件,可自动查找符号并循环设置,以优化手头特定 DPM 标记和基材的读取。事实上,这里展示的 LVS-9585 可以同时检测 DPM 零件和打印标签,以便进行全面分析和报告。(图片来源:Omron Automation)
签约实体(品牌持有人)负责
在美国,每个医疗产品的知识产权所有者和面向用户的品牌都要对 UDI 代码的准确性和质量负责。这一点尤为重要,因为医疗产品市场中的许多产品都是合同制造以及外包给其他公司的工厂。因此,签约组织有责任确保其整个供应链符合 UDI 标准并生成准确的标签。
医疗器械唯一标识技术起源
UDI 是器械静态标识符。但是,如果包装中的物品数量发生变化,可能需要使用新的标识符。由发行机构决定如何区分这些细节。同样,变更器械的包装无菌条件后,也可能需要更改器械标识符。变更器械的目标市场(器械的目标销售国家/地区)、标签语言或 CE 标记时,也可能需要更改器械标识符。
在 UDI 规则出台之前,医疗器械制造商可能会在产品上标注特定的零件编号。经销商会先更改此零件编号,然后医护人员或医院再次更改。由于每个实体都有可能在器械用于患者之前更改零件编号,因此几乎无法高效地追踪产品、处理召回、防止假冒或准确订购新库存。
相关文章:实施可靠可追溯性解决方案
现在,每个器械都有标准化且持久的标识符,即 UDI,以便所有实体能够更快、更准确地识别器械,最终减少医疗错误。该 UDI 是一个字母数字代码,包含两个关键数据:
- 医疗器械标识符
- 生产标识符
医疗器械标识符是分配给特定器械的静态标签,上面列出了贴标人(通常是医疗器械制造商)和医疗器械的具体型号。相比之下,生产标识符所包含的数据可能会有所不同,而且其中大部分数据都是可选的。包括批次和批量代码、序列号、有效期和生产日期。简而言之,可选数据可以是制造商或贴标人认为支持器械追踪需要的任何数据。
每个 UDI 标签都必须以两种形式提供这些信息:
- 人类可读形式(纯文本)
- 机器可读形式(条码或 RFID 读取器可读)
如果一个器械能满足多种医疗应用,UDI 必须直接标注在器械上,而非包装上。该规则也适用于可多次使用的医疗器械。
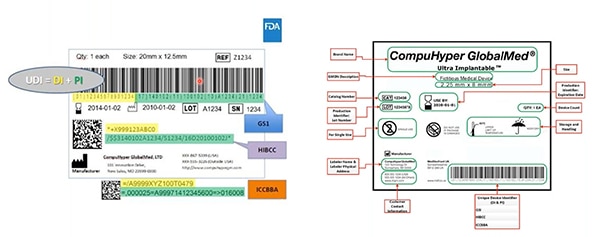 图 2:GS1、HIBCC 和 ICCBBA — UDI 发行机构 — 创建 UDI;分配 UDI 允许的符号;定义哪些技术可以与 UDI 对接;以及规定 UDI 标记的质量要求。该范本中黄色突出显示的是医疗器械标识符;绿色突出显示的是生产标识符。其他要素包括人类可读的信息...这些信息也被编码到机器可读的条码中。(图片来源:FDA)
图 2:GS1、HIBCC 和 ICCBBA — UDI 发行机构 — 创建 UDI;分配 UDI 允许的符号;定义哪些技术可以与 UDI 对接;以及规定 UDI 标记的质量要求。该范本中黄色突出显示的是医疗器械标识符;绿色突出显示的是生产标识符。其他要素包括人类可读的信息...这些信息也被编码到机器可读的条码中。(图片来源:FDA)
所有器械都必须在全球 UDI 数据库中登记,以便在发生召回时进行追踪,并让公众能够获取特定器械的信息。美国食品药品监督管理局认可的发行机构有权为医疗器械制造商生成独特的标识符,并将其贴到产品上。
相关白皮书:保持实时可追溯性
UDI 扫描技术和技巧
从 UDI 标签生产到使用的整个过程中,可以通过多种方式对其进行校验。
利用集成到大型机械中的技术来执行在线校验,可在生产过程中快速、准确地处理大量产品。这些技术辅以先进的软件,有时会采用工业级标签打印机的形式。这些打印机能够自动进行在线校验,以确认 UDI 信息在标签生产点创建后立即可读,符合严格的行业标准。例如,Omron 的 Automation V275 校验器可与 Zebra 热敏打印机配合使用,以符合 ISO 15426 和发行机构 GS1 标准,从而满足 FDA 的要求。
相关文章:Omron 可追溯性解决方案
在其他地方,在线校验借助在自动化生产线的传送带两侧安装专门的机器视觉系统,结合条码读取功能,以便在高速生产线上对多品种产品的 UDI 标签进行极其快速和准确的校验。Omron Automation 的 MicroHAWK 产品在这一领域表现出色,采用先进的传感器,并辅以小巧的结构以及 Ethernet/IP 和 PROFINET 等连接选项。
相关文章:规避贴错标签的责任
相比之下,离线 UDI 校验最适合用于标签的批量抽样,以确保质量。离线校验通常用于在医疗器械离开或到达工厂时进行样品检测,可与配送过程中的上游在线校验系统互补。
 图 3:直接标记在产品上的 UDI 与印在粘贴标签上的 UDI 需要不同的校验器。(图片来源:Omron Automation)
图 3:直接标记在产品上的 UDI 与印在粘贴标签上的 UDI 需要不同的校验器。(图片来源:Omron Automation)
事实上,所有医药分销和医疗业务都能够因使用符合 ISO 标准的校验器而获益。考虑 Omron 的 LVS 95XX 系列离线 UDI 校验产品。这些产品适用于:
- 生成代码的激光打标机和标签打印机
- 代码应用于产品的情况,可能与代码生成区域分开,也可能不分开
- 质量控制站,对模板、格式和其他代码要素进行确认
确定离线 UDI 校验器版本
可根据几个参数确定最适合特定应用的离线 UDI 校验器。
条码尺寸:大尺寸的条码通常更容易由具有大视野(由镜头焦距和传感器尺寸定义)的校验器来扫描。考虑 Omron Automation 的 LVS-9510 台式 UDI 校验器。该系列产品可读取条形和二维标签。五种不同的版本拥有不同的视场,因此设计人员可以根据需要校验的条码尺寸选择相应的版本。拼接功能可对超过视场范围的条码进行分级。
此外,所有 LVS-9510 都能自动确定评估代码所需的符号和孔径,并识别和突出故障点。
 图 4:借助可校验条形 (1D) 和二维 (2D) 码的设备,可以更轻松地校验符合 ISO 标准的条码。一些此类设备可确定评估代码所需的符号和孔径,并识别和突出问题。图示的 LVS-9510 具有拼接功能,可对大于视场的条码进行分级。(图片来源:Omron Automation)
图 4:借助可校验条形 (1D) 和二维 (2D) 码的设备,可以更轻松地校验符合 ISO 标准的条码。一些此类设备可确定评估代码所需的符号和孔径,并识别和突出问题。图示的 LVS-9510 具有拼接功能,可对大于视场的条码进行分级。(图片来源:Omron Automation)
条码类型:扫描仪必须读取由 HIBCC、ICCBBA 或(自 2023 年起最常见的)GS1 等发行机构指定的条码格式。GS1 规定了 UPC、条形码和二维码的尺寸、格式和分辨率。
UDI 标记位置:考虑医疗器械的直接零件标记 (DPM)。这些标记可能非常微小,尤其是在标识手术器械和植入式医疗器械时。为了读取和校验此类 DPM UDI,Omron 的 LVS-9580 和 LVS-9585 超高密度手持式校验器配备了专用镜头,可以对各种 DPM 进行分级,包括单元尺寸小至 0.002 in. 的 DPM。LVS-9580 和 LVS-9585 中的工业级镜头可确保一致的读取准确性。最先进的是扫描仪内部高度可控和可校准的照明技术。通过多视场照明,可以立即优化捕捉到的 UDI 图像。这一点尤为重要,因为代码标准不允许事后修正或图像处理。
有关 UDI 扫描仪软件的更多信息
为达到最佳效果,支持校验器硬件的 UDI 软件必须以直观的格式提供诊断信息。该软件必须根据 ISO 规定的参数对 UDI 代码进行分级(最重要的是确认其可读性),最好还能追踪一系列 UDI 扫描中出现的恶化问题。
Omron 的每一款 UDI 扫描硬件都随附所有必要的软件。软件定期更新,以适应快速变化的法规和新的行业立法。
Omron 扫描仪软件的一个主要功能是处理代码语法。简而言之,每个条码或二维码都必须准确提取所有相关信息,包括产品类型、批号、适用数量、有效期、运输信息等。生成的数据字符串必须以特定的方式格式化,以适应不断变化的要求、方法和医疗产品目的地。
扫描仪制造商定期更新软件,确保发布新代码时,最终用户能够及时更新。
总结
美国军方曾一度打算全面采用类似医疗行业 UDI 系统的 UID 产品追踪系统。目的是减少军事基地中因物资丢失、重复和未计数量造成的巨大浪费,包括从整套雷神武器装备到小型企业为某些特殊应用提供的控制板等一切物品。如今,UID 的使用程度参差不齐。
而 UDI 规定将全面实施。
推动 UDI 采用的口号很简单:标签即产品。毕竟,标签错误可能会引发一连串的事件,浪费医务人员的时间,并导致医疗器械被丢弃。因此,UDI 必须出现在包装的所有层面,如产品、包装、捆包、箱子和托盘层面。消毒封条内无菌医疗器械上的 UDI 尤为重要,因为不允许破坏封条来校验器械类型。
美国食品药品监督管理局 (FDA) 要求自 2023 年 9 月 24 日起全面遵守 UDI 指令,因此用于校验医疗产品的先进扫描技术对于自动化制造商及其服务的机器制造商和最终用户来说至关重要。
此类扫描仪可满足美国食品药品监督管理局 (FDA) 对 UDI 的极具针对性的要求,用于确认各种实验室、医疗和临床诊断设备上的标签。离线条码校验器最大限度地提高可追溯性、在线机器视觉和先进的 DPM 读取器。

免责声明:各个作者和/或论坛参与者在本网站发表的观点、看法和意见不代表 DigiKey 的观点、看法和意见,也不代表 DigiKey 官方政策。








